Hoe werk 'n litiumioonbattery vir 'n elektriese voertuig?
Nadat ons in 'n ander artikel die werking van die loodbattery gesien het waarmee alle motors toegerus is, kom ons kyk nou na die werkingsbeginsel van 'n elektriese motor en veral sy litiumbattery...

prins
Soos met enige tipe battery, bly die beginsel dieselfde: naamlik om energie (hier elektrisiteit) deur middel van 'n chemiese of selfs elektriese reaksie op te wek, want chemie is altyd naby elektrisiteit. Trouens, atome self word van elektrisiteit gemaak: dit is die elektrone wat om die kern wentel en wat op een of ander manier die "dop" van die atoom, of selfs sy "vel" vorm. Met die wete ook dat vrye elektrone swewende stukkies vel is wat hul tyd spandeer om van een atoom na 'n ander te beweeg (sonder om daaraan te heg), is dit slegs die geval vir geleidende materiale (hang af van die aantal lae elektrone en die aantal elektrone per laaste projektiel).
Ons sal dan 'n "velstuk" van atome (dus van sy elektrisiteit) deur 'n chemiese reaksie neem om elektrisiteit te produseer.

die basiese beginsels
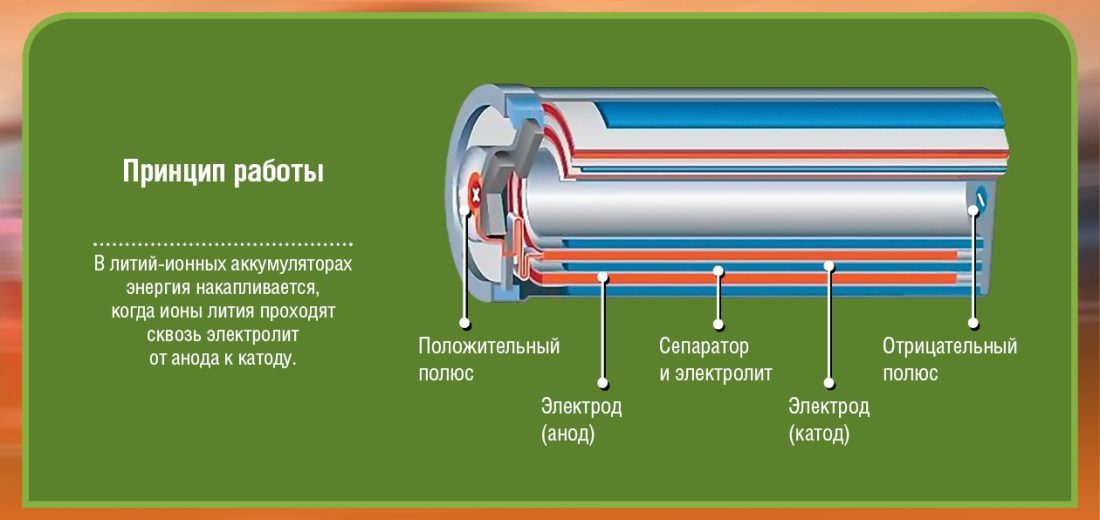
Eerstens is daar twee pole (elektrodes) wat ons noem die katode (+ terminaal: in litiumkobaltoksied) en anode (terminaal -: koolstof). Elkeen van hierdie pole bestaan uit 'n materiaal wat elektrone óf verwerp (-) óf aantrek (+). Alles is oorstroom elektroliet wat 'n chemiese reaksie (oordrag van materiaal vanaf die anode na die katode) sal moontlik maak wat tot die opwekking van elektrisiteit sal lei. 'n Versperring word tussen hierdie twee elektrodes (anode en katode) ingevoeg om kortsluitings te vermy.
Neem asseblief kennis dat die battery uit verskeie selle bestaan, wat elkeen gevorm word deur wat in die diagramme sigbaar is. As ek byvoorbeeld 2 selle van 2 volt ophoop, sal my battery-uitset slegs 4 volt wees. Om 'n masjien wat 'n paar honderd kg weeg te beweeg, stel jou voor hoeveel selle benodig word...
Wat gebeur by die toetsterrein?
Aan die regterkant is litiumatome. Hulle word in detail voorgestel: die geel hart verteenwoordig die protone, en die groen hart verteenwoordig die elektrone wat hulle wentel.
Wanneer 'n battery vol gelaai is, is alle litiumatome aan die anode (-) kant. Hierdie atome bestaan uit 'n kern (wat uit verskeie protone bestaan) met 'n positiewe elektriese krag van 3, en 3 elektrone om 'n negatiewe elektriese krag van 1 te hê (3 in totaal omdat 3 X 1 = 3). . Daarom is 'n atoom stabiel met 3 positiewe en 3 negatiewe (dit trek nie elektrone aan of verwerp nie).
Ons verwyder 'n elektron uit litium, wat eindig met slegs twee: dit word dan na + aangetrek en gaan deur die partisie.
Wanneer ek kontak maak tussen die + en – terminale (dus wanneer ek 'n battery gebruik), sal elektrone van die – terminale na die + terminale langs die elektriese draad buite die battery beweeg. Hierdie elektrone kom egter van 'n "haar" van litiumatome! Basies, uit die 3 elektrone wat om wentel, word 1 afgestamp en die atoom bly net 2 oor. Skielik is sy elektriese krag nie meer gebalanseer nie, wat ook 'n chemiese reaksie veroorsaak. Let ook op dat die litiumatoom word litiumioon+ want dit is nou positief (3 – 2 = 1 / Die kern is 3 werd en die elektrone is 2 aangesien ons een verloor het. Optelling gee 1, nie 0 soos voorheen nie. Dit is dus nie meer neutraal nie).
'n Chemiese reaksie wat voortspruit uit 'n wanbalans (nadat elektrone gebreek is om 'n stroom te skep) sal die effek hê om te stuur litiumioon + na die katode (+ terminaal) deur 'n muur wat ontwerp is om alles te isoleer. Uiteindelik beland die elektrone en ione + aan die + kant.
Wanneer die reaksie voltooi is, is die battery ontlaai. Daar is nou 'n balans tussen die + en - terminale wat nou elektrisiteit verhoed. In wese is die beginsel om depressie op 'n chemiese/elektriese vlak te veroorsaak om 'n elektriese stroom te skep. Ons kan daaraan dink soos 'n rivier, hoe meer skuins dit is, hoe belangriker sal die intensiteit van die vloeiende water wees. Aan die ander kant, as die rivier pap is, sal dit nie meer vloei nie, wat beteken die battery is dood.
Herlaai?
Herlaai bestaan uit om die proses om te keer deur elektrone in te spuit - en meer te verwyder deur hulle in te suig ('n bietjie soos om 'n rivier aan te vul sodat dit weer kan vloei). Dus word alles in die battery herstel soos dit was voordat dit ontlaai is.
Basies wanneer ons ontlaai gebruik ons 'n chemiese reaksie en wanneer ons herlaai gee ons die oorspronklike goed terug (maar daarvoor benodig jy krag en dus 'n laaistasie).
Dra?
Litiumbatterye verslyt vinniger as die goeie ou loodsuurbatterye wat al eeue lank in ons motors gebruik word. Die elektroliet is geneig om te ontbind, so ook die elektrodes (anode en katode), maar dit moet ook in ag geneem word dat 'n afsetting op die elektrodes vorm, wat die oordrag van ione van die een kant na die ander verminder... Spesiale toestelle laat toe u om gebruikte batterye te regenereer deur dit op 'n spesiale manier te ontlaai.
Die aantal moontlike siklusse (ontlading + volle herlaai) word geskat op ongeveer 1000-1500, dus met 'n halfsiklus wanneer herlaai van 50 tot 100% in plaas van 0 tot 100%. HITTE beskadig ook litiumioonbatterye grootliks, wat geneig is om te verhit wanneer te veel krag daaruit getrek word.
Lees ook: Hoe om die battery in my elektriese motor te bewaar?
Enjinkrag en battery...
Anders as 'n termiese beeldhouer, word krag nie deur die brandstoftenk beïnvloed nie. As jy 'n 400 pk-enjin het, dan sal 'n 10 liter-tenk jou nie verhoed om 400 pk te kry nie, al is dit vir 'n baie kort tydjie... Vir 'n elektriese motor is dit glad nie dieselfde nie! As die battery nie kragtig genoeg is nie, sal die enjin nie op volle krag kan loop nie... Dit is die geval met sommige modelle waar die enjin nooit tot sy uiterste gedruk kan word nie (tensy die eienaar peuter en 'n groot kaliber battery byvoeg !).
Kom ons vind nou uit: hoe 'n ELEKTRIESE MOTOR werk
Alle kommentaar en reaksies
Dernier kommentaar geplaas:
Mao (Datum: 2021, 03:03:15)
baie goeie werk
Il J. 1 reaksie (s) op hierdie opmerking:
- Administrator WERKBESTUURDER (2021-03-03 17:03:50): Hierdie opmerking is selfs beter 😉
(U plasing sal na verifikasie onder die opmerking sigbaar wees)
Skryf 'n opmerking
Hoe voel jy oor die verbruiksyfers wat deur vervaardigers verklaar word?
